
《酸和碱》重点知识整理
课题1常见的酸和碱
一、酸碱指示剂
1.概念:能与酸或碱的溶液起作用而显示不同颜色的物质。
2.石蕊溶液、酚酞溶液与酸、碱溶液的反应
石蕊溶液
酚酞溶液
本身
紫色
无色
酸溶液
红色
无色
碱溶液
蓝色
红色
二、常见的酸
1.几种常见的酸
(1)物理性质

(2)用途
盐酸:重要化工原料。用于金属表面__除锈__,制造药物等;人体胃液中含有__胃酸__,可帮助消化。
硫酸:重要化工原料。用于生产化肥、农药、火药、染料及__冶炼金属__、精炼石油和金属__除锈__等。浓硫酸有__吸水__性,在实验室中常用它做__干燥__剂。
2.浓硫酸的腐蚀性
(1)浓硫酸有强烈的_腐蚀性,它能夺取纸张、面料等含碳物质里的水分,生成黑色__炭。
(2)浓硫酸的稀释:在稀释浓硫酸时,一定要把__浓硫酸__沿着器壁慢慢注入__水__中,并不断搅拌。切不可将__水倒入浓硫酸__中。
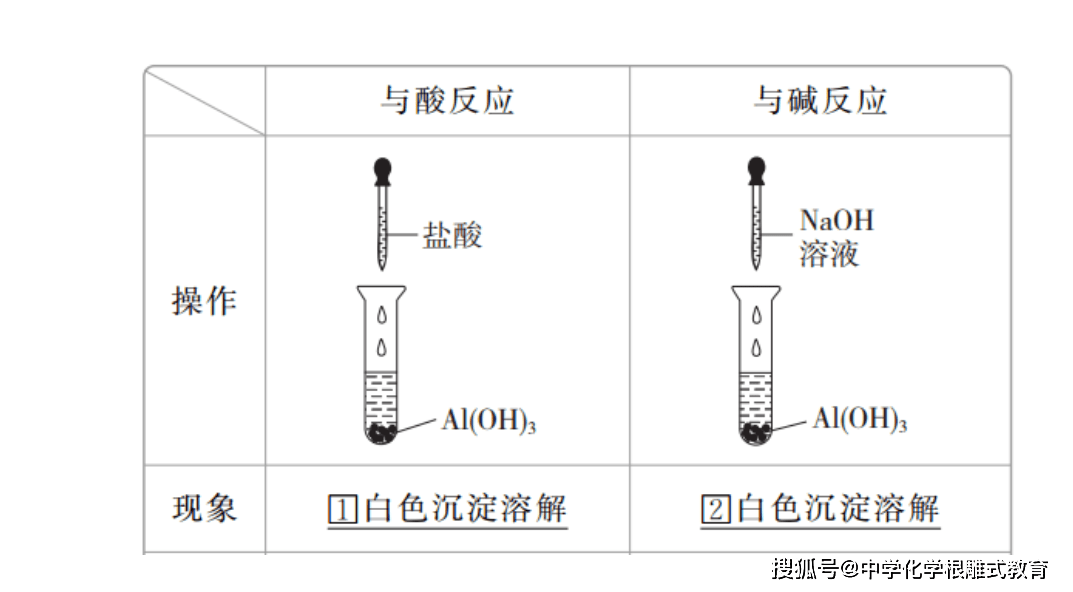
3.酸的化学性质
由于在不同的酸溶液中都含有相同的__H+__,所以,酸有一些相似的化学性质。
(1)与酸碱指示剂反应:紫色石蕊试液遇到酸溶液__变红__,无色酚酞试液遇到酸溶液__不变色(或呈无色)__。
(2)与活泼金属反应,生成__盐__和__氢气(或H2)__。如:
铁与稀盐酸反应,化学方程式是__Fe+2HCl===FeCl2+H2↑__,
锌与稀硫酸反应,化学方程式是__Zn+H2SO4===ZnSO4+H2↑__。
(3)与金属氧化物反应,生成__盐__和__水__。如:
氧化铁与稀盐酸反应,化学方程式是__Fe2O3+6HCl===2FeCl3+3H2O__,
氧化铜与稀硫酸反应,化学方程式是__CuO+H2SO4===CuSO4+H2O__。
(4)与碱反应,生成__盐__和__水__。如:氢氧化钠与稀盐酸反应,化学方程式是
__NaOH+HCl===NaCl+H2O__,
氢氧化钙与稀硫酸反应,化学方程式是__Ca(OH)2+H2SO4===CaSO4+2H2O__。
(5)与某些盐反应,生成__新酸__和__新盐__。如:
硝酸银溶液与稀盐酸反应,化学方程式是__AgNO3+HCl===AgCl↓+HNO3__,
碳酸钠溶液与稀硫酸反应,化学方程式是_Na2CO3+H2SO4===Na2SO4+H2O+CO2↑__。
三、常见的碱
1.氢氧化钠
(1)有强烈的__腐蚀__性,所以它的俗名叫作__苛性钠__、__火碱__和__烧碱__。
(2)氢氧化钠是__白色__固体,__极易__溶于水,溶于水时__放出__大量的热。
(3)氢氧化钠暴露在空气中容易吸收水分,表面潮湿并逐渐溶解,这种现象叫作__潮解__。因此,氢氧化钠可做某些气体的__干燥剂__。
(4)用途:重要的化工原料,广泛应用__肥皂__、石油、__造纸__、纺织和印染等工业。在生活中可用去除__油污__。
2.氢氧化钙
(1)氢氧化钙俗称__熟石灰__或__消石灰__。它是__白色粉末__状固体,__微__溶于水,其水溶液俗称__石灰水__。
(2)氢氧化钙可由__生石灰__和水反应得到,化学方程式是__CaO+H2O===Ca(OH)2__。
(3)用途:如建筑上用__石灰浆__刷墙壁,农业上配制波尔多液,改良__酸性__土壤等。
3.碱的化学性质
由于在不同的碱溶液中都含有相同的__OH-__,所以,碱有一些相似的化学性质。
(1)与酸碱指示剂反应:紫色石蕊试液遇到碱溶液__变蓝__,无色酚酞试液遇到碱溶液__变红__。
(2)与非金属氧化物反应,生成__盐__和__水__。如:氢氧化钠溶液与二氧化碳反应,化学方程式是__CO2+2NaOH===Na2CO3+H2O__;
氢氧化钠易吸收空气中的__水分__而潮解,又能与空气中的CO2反应而__变质__配制波尔多液化学方程式是,故NaOH必须__密封__保存。
石灰水与二氧化碳反应,化学方程式是__CO2+Ca(OH)2===CaCO3↓+H2O__。
(3)与酸反应,生成__盐__和__水__。如:
氢氧化钠与稀硫酸与反应,化学方程式是__2NaOH+H2SO4===Na2SO4+2H2O__,
氢氧化钙溶液与盐酸反应,化学方程式是__Ca(OH)2+2HCl===CaCl2+2H2O__。
(4)与某些盐反应,生成__新盐__和__新碱__。如:
氢氧化钠溶液与硫酸铜溶液反应,化学方程式是_CuSO4+2NaOH===Cu(OH)2↓+Na2SO4_,碳酸钠与氢氧化钙溶液反应,化学方程式是Na2CO3+Ca(OH)2===CaCO3↓+2NaOH_。
课题2酸和碱的中和反应
一、中和反应
1.概念:__酸和碱__作用生成__盐和水__的反应,叫作中和反应。
2.反应实质(用符号表示):OH-+H+===H2O__
3.盐是在水溶液中能解离出__金属离子__和__酸根离子__的化合物。
二、中和反应在实际中的应用
1.农业生产中,在土壤中加入__酸性__或__碱性__物质,调节土壤的酸碱性。
2.工厂中的污水处理,如硫酸厂的污水中含有硫酸等杂质,可以用__熟石灰__进行中和处理等。
3.人的胃液里含有适量__盐酸__,可帮助消化。但有时胃会分泌出过量胃酸,这时可遵医嘱服用某些含有__碱性__物质的药物。
4.人被蚊虫叮咬后配制波尔多液化学方程式是,叮咬处会很快肿成大包。是因为蚊虫能在人的皮肤内分泌出蚁酸。为了减轻痛痒,可以涂一些含有__碱性__物质的溶液,就可减轻痛痒。
三、pH
1.溶液的__酸碱度__可用pH表示,用__pH试纸__可以测定溶液的酸碱度。
pH__<__7,溶液为酸性;
pH__=__7,溶液为中性;
pH__>__7,溶液为碱性。
限 时 特 惠: 本站每日持续更新海量各大内部创业教程,加站长微信免费获取积分,会员只需38元,全站资源免费下载 点击查看详情
站 长 微 信: thumbxmw

